Materi Persamaan Reaksi Kimia Kelas X
Persamaan Reaksi Kimia
Pembelajaran ini diawali dengan pertanyaan �Apakah reaksi kimia itu?�. Suatu zat dikatakan mengalami perubahan kimia jika zat tersebut berubah menjadi zat baru yang berbeda sifat dari zat asalnya. Perubahan kimia disebut juga reaksi kimia.
Apa yang terjadi ketika berlangsungnya reaksi kimia?
Reaksi kimia banyak sekali terjadi di alam. Contohnya, besi berkarat, apel yang dikupas kulitnya jika dibiarkan beberapa saat, akan berubah menghitam dan banyak lagi contohnya lainnya di alam. Reaksi kimia juga terjadi di laboratorium. Reaksi kimia yang terjadi di laboratorium ditandai oleh beberapa ciri, di antaranya pembentukan endapan, pembentukan gas, perubahan warna, atau perubahan panas.
Dalam mempelajari kimia, diperlukan suatu persamaan reaksi kimia sebagai simbol adanya suatu reaksi kimia. Penulisan persamaan reaksi membutuhkan aspek kuantitatif dan aspek kualitatif.
1. Aspek Kuantitatif
Penyetaraan koefisien pereaksi dan hasil reaksi berdasarkan hukum kekekalan massa, yaitu jumlah massa sebelum reaksi sama dengan jumlah massa sesudah reaksi. Dengan demikian, reaksi dapat menunjukkan jumlah setiap zat yang terlibat dalam reaksi.
Satu mol adalah banyaknya zat yang mengandung partikel-partikel zat itu sebanyak atom yang terkandung dalam 12 gram 12C sebanyak 6,023 � 1023 (tetapan Avogrado). Anda akan mempelajari konsep mol lebih mendalam pada materi selanjutnya mengenai
Contoh persamaan reaksi antara hidrogen dan oksigen sebagai berikut.
2H2(g) + O2(g) ? 2H2O(g)
Persamaan reaksi kimia tersebut menunjukkan bahwa �2 mol hidrogen bereaksi dengan 1 mol oksigen menghasilkan 2 mol air�.
2. Aspek Kualitatif
Pemberian tanda (simbol) sifat fisik dari pereaksi-pereaksi dan hasil reaksi, yaitu:
a. simbol solid (s) diberikan untuk zat padat,
b. simbol liquid (l) diberikan untuk zat cair,
c. simbol gases (g) diberikan untuk gas; dan
d. simbol aqueous (aq) diberikan untuk zat larutan.
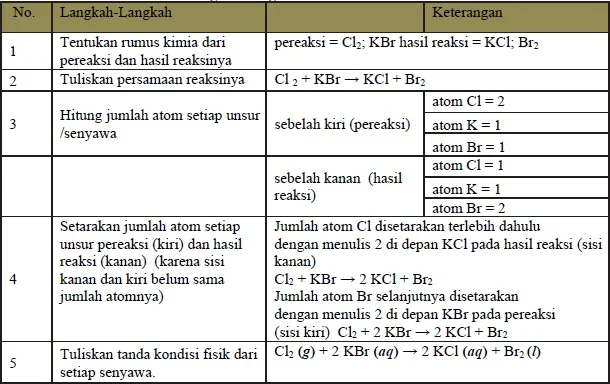
Langkah-langkah penulisan suatu persamaan reaksi dapat ditulis sebagai berikut.
Misalkan dalam perkataan, dapat ditulis persamaan sebagai berikut:
klorin + kalium bromida ---> kalium klorida + bromin
Contoh 1:
Soal
Setarakan persamaan reaksi berikut.
NaOH(aq) + HCl(aq) --> NaCl(aq) + H2O(l)
Persamaan reaksi tersebut sudah setara karena jumlah atom di sisi kiri dan kanan sudah sama.
Jawab :
Contoh 2
Soal
Setarakan persamaan reaksi berikut.
C3H8(g) + O2(g) --> CO2(g) + H2O(l)
Jawaban:
Ada beberapa pertimbangan dan trik yang dipakai untuk memudahkan dalam penyetaraan persamaan reaksi. Atom C dan atom H harus disetarakan terlebih dahulu, kemudian setarakan atom O.
Sisi kanan Jumlah atom C dikalikan 3 sehingga menjadi 3 CO2
Jumlah atom H di kanan dikalikan 4 sehingga menjadi 4 H2O
Jumlah atom O di kanan menjadi 10
Sisi kiri Jumlah atom O di kiri harus dikalikan 5 menjadi 5 O2 sehingga jumlah atom O menjadi 10.
Jadi, persamaan reaksinya yaitu:
C3H8(g) + 5O2(g) --> 3CO2(g) + 4H2O(g)
Pembelajaran ini diawali dengan pertanyaan �Apakah reaksi kimia itu?�. Suatu zat dikatakan mengalami perubahan kimia jika zat tersebut berubah menjadi zat baru yang berbeda sifat dari zat asalnya. Perubahan kimia disebut juga reaksi kimia.
Apa yang terjadi ketika berlangsungnya reaksi kimia?
Reaksi kimia banyak sekali terjadi di alam. Contohnya, besi berkarat, apel yang dikupas kulitnya jika dibiarkan beberapa saat, akan berubah menghitam dan banyak lagi contohnya lainnya di alam. Reaksi kimia juga terjadi di laboratorium. Reaksi kimia yang terjadi di laboratorium ditandai oleh beberapa ciri, di antaranya pembentukan endapan, pembentukan gas, perubahan warna, atau perubahan panas.
Dalam mempelajari kimia, diperlukan suatu persamaan reaksi kimia sebagai simbol adanya suatu reaksi kimia. Penulisan persamaan reaksi membutuhkan aspek kuantitatif dan aspek kualitatif.
1. Aspek Kuantitatif
Penyetaraan koefisien pereaksi dan hasil reaksi berdasarkan hukum kekekalan massa, yaitu jumlah massa sebelum reaksi sama dengan jumlah massa sesudah reaksi. Dengan demikian, reaksi dapat menunjukkan jumlah setiap zat yang terlibat dalam reaksi.
Satu mol adalah banyaknya zat yang mengandung partikel-partikel zat itu sebanyak atom yang terkandung dalam 12 gram 12C sebanyak 6,023 � 1023 (tetapan Avogrado). Anda akan mempelajari konsep mol lebih mendalam pada materi selanjutnya mengenai
Contoh persamaan reaksi antara hidrogen dan oksigen sebagai berikut.
2H2(g) + O2(g) ? 2H2O(g)
Persamaan reaksi kimia tersebut menunjukkan bahwa �2 mol hidrogen bereaksi dengan 1 mol oksigen menghasilkan 2 mol air�.
2. Aspek Kualitatif
Pemberian tanda (simbol) sifat fisik dari pereaksi-pereaksi dan hasil reaksi, yaitu:
a. simbol solid (s) diberikan untuk zat padat,
b. simbol liquid (l) diberikan untuk zat cair,
c. simbol gases (g) diberikan untuk gas; dan
d. simbol aqueous (aq) diberikan untuk zat larutan.
Langkah-langkah penulisan suatu persamaan reaksi dapat ditulis sebagai berikut.
Misalkan dalam perkataan, dapat ditulis persamaan sebagai berikut:
klorin + kalium bromida ---> kalium klorida + bromin
Contoh 1:
Soal
Setarakan persamaan reaksi berikut.
NaOH(aq) + HCl(aq) --> NaCl(aq) + H2O(l)
Persamaan reaksi tersebut sudah setara karena jumlah atom di sisi kiri dan kanan sudah sama.
Jawab :
Contoh 2
Soal
Setarakan persamaan reaksi berikut.
C3H8(g) + O2(g) --> CO2(g) + H2O(l)
Jawaban:
Ada beberapa pertimbangan dan trik yang dipakai untuk memudahkan dalam penyetaraan persamaan reaksi. Atom C dan atom H harus disetarakan terlebih dahulu, kemudian setarakan atom O.
Sisi kanan Jumlah atom C dikalikan 3 sehingga menjadi 3 CO2
Jumlah atom H di kanan dikalikan 4 sehingga menjadi 4 H2O
Jumlah atom O di kanan menjadi 10
Sisi kiri Jumlah atom O di kiri harus dikalikan 5 menjadi 5 O2 sehingga jumlah atom O menjadi 10.
Jadi, persamaan reaksinya yaitu:
C3H8(g) + 5O2(g) --> 3CO2(g) + 4H2O(g)